動物における生殖機構の“なぜ”を科学する
はじめに
近年生殖工学的技術は著しい進歩を遂げ、生命科学研究の発展に著しく貢献しました。しかし、ヒト不妊症における原因不明不妊やウシ人工授精における受胎率低下など、まだまだ解決の糸口が見つからない問題は多く残されています。このような状況を踏まえ、私たちのグループでは動物の生殖機構を制御している分子基盤の解明を進め、得られた成果を基に新たな家畜生産や生殖医療技術の開発を目指しています。
研究テーマ1: 膜ラフトマイクロドメインの受精における役割
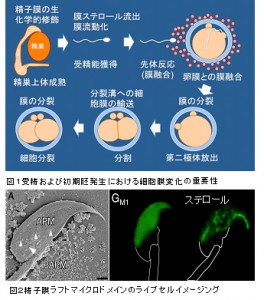
遺伝子の転写翻訳活性を欠いている精子は、様々に細胞膜の分子構成を変化させ、受精機能を獲得します(図1:精巣上体成熟、受精能獲得、先体反応)。また細胞膜の変化は初期胚においても重要な機能を果たしています(図1)。このような個別の細胞膜現象が作り出す一連の受精メカニズムはどのように制御されているのでしょうか?
膜ラフトマイクロドメインは、ステロール、ガングリオシドGM1および機能性膜タンパクを豊富に含む生体膜マイクロドメインで、様々な細胞生理現象の時空間制御に関わることが明ら
かになってきました。
最近私達は、ライブセルイメージングでマウス精子が先体原形質膜(APM)に膜ラフトマイクロドメインを保持していること(図2)1)、さらに膜ラフトは受精において重要な役割を果たしていることを突き止めました2, 3)。
そこで本研究では、精子および受精卵において膜ラフトマイクロドメインの機能的役割の解明と共に、得られた知見を基に受精能力制御技術の開発を進めています。
1) Selvaraj V*, Asano A* et al., J Cell Physiol (2006). (*equal contribution)
2) Asano A et al., PROTEOMICS (2010).
3) Asano A et al., J Bio Chem (2013).
研究テーマ2: 精巣上体成熟のメカニズム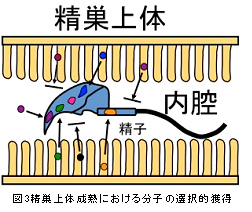
精巣で形態分化を終えた精子は、精巣上体を通過しながら、外環境から様々な機能性タンパクや脂質を選択的に細胞膜へ取り込むことで受精能力を獲得します(図3)。この精巣上体成熟と呼ばれる細胞膜の生化学的変化は、運動性の獲得や受精能獲得および先体反応の誘起などに必須です(図1)。最近、原因不明の雄性不妊症に精巣上体成熟の活性低下が関わっていることが明らかになりました。しかし、精子の精巣上体成熟メカニズムの全容には未だ不明な点が多く残されています。
そこで本研究では、哺乳動物精子の精巣上体成熟機構の解明を進め、得られた知見を通して雄性不妊症の原因究明に取り組んでいます。
研究テーマ3:幹細胞工学を応用した動物遺伝資源の保存・増殖に関わる技術
受精卵は増殖を繰り返しながら、体を形作る機能を有す特定の細胞へと分化を遂げます。この劇的な変化の中には、いったい何が起こっているのでしょうか?この問いに答えることが出来れば、既に特定の細胞へと最終分化を遂げた細胞を未分化の状態に戻し、再び個体を再生することが出来ると考えられます。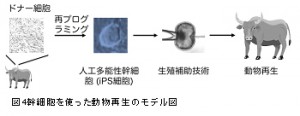 人工多能性幹(iPS)細胞は特定細胞を人工的に初期化した未分化細胞で、実験動物レベルでは個体の再生にも成功しています。最近、絶滅が危惧されている動物の体細胞において iPS細胞の作製が報告されたことから、今後この手法は希少動物の増殖や絶滅動物の再生に発展すると
人工多能性幹(iPS)細胞は特定細胞を人工的に初期化した未分化細胞で、実験動物レベルでは個体の再生にも成功しています。最近、絶滅が危惧されている動物の体細胞において iPS細胞の作製が報告されたことから、今後この手法は希少動物の増殖や絶滅動物の再生に発展すると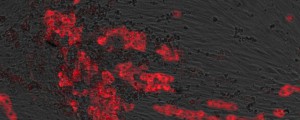 考えられます。そこで本研究では、体細胞からiPS細胞を誘導する初期化メカニズムの全容解明を進めると共に、iPS細胞を使った野生動物の再生に必要な周辺技術の開発を進めています。
考えられます。そこで本研究では、体細胞からiPS細胞を誘導する初期化メカニズムの全容解明を進めると共に、iPS細胞を使った野生動物の再生に必要な周辺技術の開発を進めています。